Disulfure
Dans cet article, nous explorerons en profondeur Disulfure et ses nombreuses implications dans la société actuelle. De son impact sur l'économie à son influence sur la culture populaire, Disulfure a fait l'objet de débats et d'analyses dans différents domaines. Au fil des années, Disulfure s’est avéré être un sujet d’intérêt non seulement pour les spécialistes et les universitaires, mais aussi pour le grand public. A travers cet article, nous tenterons de mettre en lumière les aspects les plus pertinents de Disulfure, en analysant son évolution au fil du temps et en examinant les différentes perspectives qui existent sur ce sujet. Préparez-vous à vous lancer dans un fascinant voyage de découverte de Disulfure et de ses nombreuses facettes !
En chimie, disulfure désigne généralement le groupe fonctionnel constitué de deux atomes de soufre liés par une liaison covalente simple.
Pont disulfure
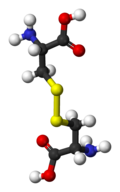
On appelle pont disulfure tout groupe disulfure dont les atomes de soufre sont chacun liés par covalence à un atome de carbone d'un composé organique. Cela peut s'écrire de façon générique R1–S–S–R2, R1 et R2 étant des résidus organiques. C'est par exemple le cas du disulfure de diphényle C6H5–S–S–C6H5, de la cystine HOOC–HCNH2–CH2–S–S–CH2–HCNH2–COOH — dimère de cystéines liées par leur atome de soufre — ou encore de l'acide lipoïque HOOC–CH2–CH2–CH2–CH2–C3H5S2, dans lequel le disulfure ferme un hétérocycle.
Anion disulfure
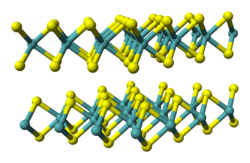
L'anion disulfure a pour formule S22−, également écrit −S–S−. Contrairement à l'anion sulfure S2−, de nombre d'oxydation –2 avec la configuration électronique de l'argon (un gaz noble), l'anion disulfure S22− est constitué de deux anions de soufre S− dont le nombre d'oxydation est –1 et la configuration électronique est celle du chlore, un halogène : ces anions S− tendent ainsi à se lier avec d'autres anions S− pour former l'anion disulfure S22−. On trouve ce dernier par exemple dans le disulfure de fer FeS2
Par extension
On parle également de disulfures pour désigner des composés qui contiennent deux anions sulfure S2−. Contrairement aux cas précédents, ces espèces chimiques ne contiennent pas de liaison covalente simple S–S. C'est typiquement le cas du disulfure de carbone CS2, dont la formule développée s'écrit S=C=S ; le disulfure de molybdène MoS2 ne possède pas non plus de liaison S–S.
Voir aussi
Articles connexes
Liens externes
- Ressource relative à la santé :
- Ressource relative à la recherche :
- Notice dans un dictionnaire ou une encyclopédie généraliste :