Métabisulfite de sodium
Métabisulfite de sodium est un sujet qui a retenu l'attention de nombreuses personnes ces dernières années. L'importance de cette Métabisulfite de sodium réside dans son impact sur différents domaines de la société, de la santé à l'économie. Il s’agit d’un sujet qui a généré des controverses et des débats, encourageant les experts et les particuliers à rechercher des informations et des opinions sur le sujet. Dans cet article, nous explorerons différentes perspectives et aspects liés à Métabisulfite de sodium, dans le but de comprendre sa pertinence et comment elle peut influencer nos vies.
| Métabisulfite de sodium | |
| |
| Identification | |
|---|---|
| Synonymes |
pyrosulfite de sodium |
| No CAS | |
| No ECHA | 100.028.794 |
| No CE | 231-673-0 |
| No RTECS | UX8225000 |
| PubChem | |
| No E | E223 |
| SMILES | |
| InChI | |
| Apparence | Poudre blanche à jaune |
| Propriétés chimiques | |
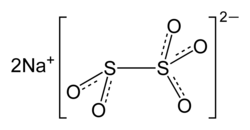
| Formule | Na2O5S2 |
| Masse molaire[1] | 190,107 ± 0,012 g/mol Na 24,19 %, O 42,08 %, S 33,73 %, 190,107 g/mol |
| Propriétés physiques | |
| T° fusion | 170 °C |
| Solubilité | 54 g/100 mL à 20 °C 81,7 g/100 mL à 100 °C |
| Masse volumique | 1,48 g·cm-3 |
| Précautions | |
| NFPA 704 | |
| Directive 67/548/EEC | |
| Composés apparentés | |
| Autres cations | métabisulfite de potassium |
| Autres anions | sulfite de sodium bisulfite de sodium |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le métabisulfite de sodium ou pyrosulfite de sodium est un désinfectant, antioxydant et conservateur alimentaire jaunâtre.
L'IUPAC nomme l'ion S2O52− l'ion disulfite[2]. Il ne doit pas être confondu avec l'ion bisulfite HSO3− qui est l'ancien nom de hydrogénosulfite.
Préparation
Le métabisulfite de sodium peut être préparé par évaporation d'une solution de bisulfite de sodium saturé avec du dioxyde de soufre: 2 HSO3−⇌ H2O + S2O52− ce qui laisse Na2S2O5 solide[3].
Structure
L'anion métabisulfite est un hybride de dithionite (S2O42−) et dithionate (S2O62−). Il est constitué d'un groupe SO2 lié à un groupement SO3, avec la charge négative plus localisée sur l'extrémité de SO3. La longueur de la liaison S-S est 2.22 Å et les longueurs des liaisons S-O sont de 1,46 et 1,50 Å pour "thionate" et "thionite" respectivement[3]..
Propriété chimique
Lorsque mélangé avec de l'eau, le métabisulfite de sodium libère du dioxyde de soufre (SO2), un gaz à odeur âcre désagréable qui peut également provoquer des difficultés respiratoires chez certaines personnes. Pour cette raison, le métabisulfite de sodium est maintenant moins utilisé comparativement à d'autres produits tels que le peroxyde d'hydrogène qui est de plus en plus populaire pour une stérilisation efficace et inodore. Cependant, le dioxyde de soufre (SO2) libéré dans l'eau est un agent réducteur fort qui est également très efficace.
Le métabisulfite de sodium libère du dioxyde de soufre en contact avec de l'eau:
- Na2S2O5 + H2O → 2 Na+ + 2 HSO3−
- HSO3− + H+ → SO2 + H2O
Le métabisulfite de sodium libère du dioxyde de soufre en contact avec un acide fort :
- Na2S2O5 + 2 HCl → 2 NaCl + H2O + 2 SO2
Il libère du dioxyde de soufre par chauffage à haute température, laissant comme résidu du sulfite de sodium[4] :
- Na2S2O5 → Na2SO3 + SO2
Utilisations
Additif alimentaire
Il est utilisé comme agent de conservation et antioxydant dans les aliments et est également connu comme E223[5].
Il peut provoquer des réactions allergiques chez les personnes qui sont sensibles aux sulfites, y compris des réactions asthmatiques et l'anaphylaxie[6],[7].
Le métabisulfite de sodium et le métabisulfite de potassium sont les principaux ingrédients des comprimés CAMPDEN utilisés pour la fabrication du vin et de la bière[8].
La dose journalière admissible est jusqu'à 0,7 mg par kg de poids corporel[9]. Le métabisulfite de sodium n'a pas d'effets secondaires, il est oxydé dans le foie en sulfate inoffensif et excrété dans l'urine[10].
Agent d'assainissement et de nettoyage
Il est couramment utilisé dans le brassage et la vinification pour désinfecter les équipements. Il est utilisé comme agent de nettoyage pour les membranes d'osmose inverse utilisées dans le traitement de l'eau potable et pour les systèmes de dessalement. Il est également utilisé pour éliminer le chloramine de l'eau potable après le traitement.
Autres utilisations
- Ajoutés aux solutions d'anesthésique local (lidocaïne, etc), il empêche l'oxydation de l'adrénaline vasoconstricteur et donc améliore la durée de conservation des solutions.
- Il est utilisé dans la photographie[11].
- Le métabisulfite de sodium concentré peut être utilisé pour enlever des souches. Certaines marques contiennent 98 % de métabisulfite de sodium qui cause la dégradation de la lignine dans les souches facilitant ainsi l'enlèvement[12].
- Il est également utilisé comme excipient dans certains comprimés, comme le paracétamol. Environ 0,5 mg est utilisé dans l'adrénaline auto-injectable comme l'EpiPen.
- Cette substance est utilisée dans les tests diagnostiques de drépanocytose et d'autres formes similaires de mutation de l'hémoglobine. Elle est ajoutée à un frottis de sang et provoque la polymérisation des cellules mortes leur donnant un aspect en faucille (confirmant ainsi la maladie).
- Il est également utilisé pour précipiter l'or à partir d'acide aurique (or dissous dans l'eau régale).
- Il est utilisé dans le traitement des déchets pour réduire chimiquement le chrome hexavalent en chrome trivalent à qui peut ensuite être précipité et éliminé à partir d'un flux de déchets aqueux.
- Il est utilisé comme agent de blanchiment dans la production de la crème de coco.
- Il est utilisé comme une source de SO2 (mélangé avec de l'air ou de l'oxygène) pour la destruction du cyanure dans les procédés de cyanuration de l'or commercial.
Voir aussi
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Red book p. 130
- (en) Catherine E. Housecroft et Alan G. Sharpe, Inorganic Chemistry, 3rd Edition, Pearson, , 368 p. (ISBN 978-0-13-175553-6, lire en ligne), « Chapter 16: The group 16 elements », p. 520
- ↑ Sodium sulfite. http://www.chemicalbook.com/ChemicalProductProperty_EN_cb4111698.htm
- ↑ http://www.eufic.org/upl/1/en/doc/EUFIC%20e-number%20mini%20guide%202.pdf
- ↑ Dean D. Metcalfe, Ronald A. Simon, Food allergy: adverse reactions to food and food additives, Wiley-Blackwell 2003, p. 324-339
- ↑ http://www.ific.org/publications/brochures/asthmabroch.cfm « Copie archivée » (version du sur Internet Archive)
- ↑ (en) Milne, George W. A., Gardner's commercially important chemicals : synonyms, trade names, and properties, New York, Wiley-Interscience, , 568 p. (ISBN 0-471-73518-3)
- ↑ (en) « E223 : Sodium disulphite », sur food-info.net (consulté le ).
- ↑ Food-Info.net : E-numbers : E223: Sodium disulphite
- ↑ http://silvergrain.com/labs/Metabisulfite
- ↑ http://www.bonideproducts.com/lbonide/msds/msds271.pdf
