Triazane
Dans cet article, nous allons approfondir le sujet de Triazane et explorer ses nombreuses facettes. Triazane est un sujet qui a suscité un grand intérêt dans divers domaines, de la science à la culture populaire. Tout au long de l’histoire, Triazane a fait l’objet de débats, de recherches et de réflexions, et reste d’actualité aujourd’hui. Nous approfondirons les différentes perspectives qui existent sur Triazane, en abordant son importance, ses implications et son impact sur la société. A travers cet article, nous souhaitons proposer une vision complète et actualisée de Triazane, dans le but d’enrichir les connaissances et de favoriser la réflexion sur ce sujet passionnant.
| Triazane | |
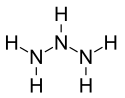
| |
| Structure du triazane | |
| Identification | |
|---|---|
| No CAS | |
| PubChem | 446953 |
| ChEBI | 50155 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | N3H5 |
| Masse molaire[1] | 47,059 8 ± 0,001 g/mol H 10,71 %, N 89,29 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le triazane est un composé chimique de formule H2N–NH–NH2[2]. C'est le troisième élément de la série homologue des azanes acycliques NnHn+2, après l'ammoniac NH3 et l'hydrazine N2H4.
On peut obtenir du triazane en faisant réagir de l'ammoniac dans une zéolithe avec un revêtement d'argent[3]. Il peut également être obtenu sous forme de chlorhydrate en faisant réagir l'hydrazine avec de la chloramine NH2Cl dans l'éther éthylique ; ce produit est cependant instable et se désintègre immédiatement[4].
Il n'est en pratique possible d'isoler que des sels de triazane comme le sulfate de triazanium 23 et non la forme basique libre. Les tentatives pour convertir des sels de triazanium en base libre n'aboutissent qu'à la formation d'ammoniac NH3 et de diimide HN=NH[5].
Du triazane peut être produit par irradiation électronique de glace d'ammoniac et être ensuite détecté comme produit gazeux stable après sublimation[6].
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) « Triazane », IUPAC, Compendium of Chemical Terminology , Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- ↑ (en) Reinhard Haubold, Claudia Heinrich-Sterzel, Ulrike Ohms-Bredeman, Carol Strametz, Gmelin Handbook of Inorganic and Organometallic Chemistry, N. Springer Science & Business Media, 1993, p. 167. (ISBN 3-662-06336-0)
- ↑ (de) A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie, 101e éd., Walter de Gruyter, Berlin 1995, p. 669–670. (ISBN 3-11-012641-9)
- ↑ (en) Nils Wiberg, A. F. Holleman et Egon Wiberg, Holleman-Wiberg's Inorganic Chemistry, 1re éd., Academic Press, 2001, p. 627. (ISBN 978-0-12-352651-9)
- ↑ (en) Marko Förstel, Pavlo Maksyutenko, Brant M Jones, Bing-Jian Sun, Shih-Hua Chen, Agnes H.-H. Chang et Ralf I. Kaiser, « Detection of the Elusive Triazane Molecule (N3H5) in the Gas Phase », Chemphyschem, vol. 16, no 15, , p. 3139-3142 (PMID 26331382, DOI 10.1002/cphc.201500560, lire en ligne)