Sulfamide
Dans cet article, nous allons analyser en profondeur Sulfamide, un sujet d'une grande pertinence et d'un grand intérêt aujourd'hui. De ses origines à son impact sur la société actuelle, Sulfamide a suscité un débat et un intérêt croissant parmi les experts et le grand public. Au fil des prochaines lignes, nous explorerons les différents aspects entourant Sulfamide, de son importance historique à son influence dans différents domaines de la vie quotidienne. De plus, nous examinerons différentes perspectives et opinions sur Sulfamide, dans le but d'offrir une vue complète et objective de ce sujet.
| Sulfamide | |
 Structure du sulfamide |
|
| Identification | |
|---|---|
| Nom UICPA | Sulfamide |
| Synonymes |
Diamine sulfurique, sulfamamide, sulfurylamide |
| No CAS | |
| No ECHA | 100.029.330 |
| No CE | 232-262-9 |
| SMILES | |
| Apparence | Solide cristallin blanc |
| Propriétés chimiques | |
| Formule | H4N2O2S SO2(NH2)2 |
| Masse molaire[1] | 96,109 ± 0,006 g/mol H 4,19 %, N 29,15 %, O 33,29 %, S 33,36 %, |
| Propriétés physiques | |
| T° fusion | 93 °C |
| T° ébullition | 250 °C (décomposition) |
| Solubilité | soluble dans l'eau |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le sulfamide, également appelé amide sulfurique, est un composé chimique de formule SO2(NH2)2. C'est un solide blanc, cristallisé dans le système orthorhombique.
On prépare le sulfamide en faisant réagir de l'ammoniac avec du chlorure de sulfuryle.
Groupe fonctionnel sulfamide
En chimie organique, le terme sulfamide peut également renvoyer au groupe fonctionnel formé par une chaîne organique liée à l'un des atomes d'azote du sulfamide. Ce sont les sulfamidés. Les sulfamides symétriques peuvent être préparés directement à partir d'amines et de dioxyde de soufre SO2 gazeux[2] :
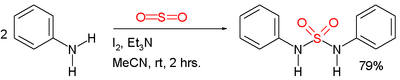
Préparation de sulfonamide à partir d'aniline et de dioxyde de soufre.
Dans cet exemple, les réactifs sont l'aniline, la triéthylamine et l'iode. On pense que le dioxyde de soufre est activé par une série d'intermédiaires : Et3N+SO2−, Et3N-I+I− et Et3N+SO2−.
Références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Sulfamides and sulfamide polymers directly from sulfur dioxide Alexander V. Leontiev, H. V. Rasika Dias and Dmitry M. Rudkevich Chem. Commun., 2006, 2887 - 2889, DOI 10.1039/b605063h
