Thiocyanate de cobalt(II)
Dans cet article, nous explorerons le monde fascinant de Thiocyanate de cobalt(II), qui a suscité l'intérêt de nombreux chercheurs, experts et passionnés ces dernières années. Depuis ses origines jusqu'à son impact sur la société contemporaine, Thiocyanate de cobalt(II) a joué un rôle important dans un large éventail de domaines, de la science et de la technologie à la culture populaire et à la politique. Tout au long de ces pages, nous examinerons les nombreuses facettes de Thiocyanate de cobalt(II), ainsi que ses implications et perspectives pour l'avenir. Préparez-vous à vous lancer dans un voyage captivant et révélateur qui mettra au défi votre compréhension de Thiocyanate de cobalt(II) et vous amènera à contempler son importance dans le monde d'aujourd'hui. .
| Thiocyanate de cobalt(II) | |||
| |||
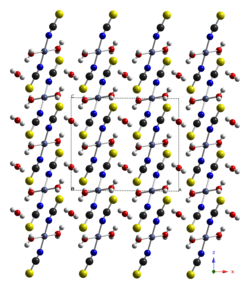
| Structure cristalline de Co(SCN)2·3H2O. En noir : atomes de carbone ; bleu : azote ; rouge : oxygène ; jaune : soufre ; gris clair : hydrogène ; gris foncé : cobalt. | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.019.234 | ||
| No CE | 221-156-8 | ||
| PubChem | 18174 | ||
| Propriétés chimiques | |||
| Formule | CoS2C2N2 | ||
| Masse molaire[1] | 175,098 ± 0,012 g/mol C 13,72 %, Co 33,66 %, N 16 %, S 36,63 %, |
||
| Propriétés physiques | |||
| Solubilité | 100 g·l-1 eau[2] | ||
| Cristallographie | |||
| Système cristallin | Monoclinique | ||
| Précautions | |||
| SGH[2] | |||
| H302, H312, H332, H410, P273, P280 et P501 |
|||
| Transport | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le thiocyanate de cobalt(II), de formule semi-développée Co(SCN)2, est un composé inorganique ionique contenant un cation Co2+ et deux anions thiocyanates, –. Il est surtout connu pour le test au thiocyanate de cobalt, ou test de Scott, un test de dépistage de la cocaïne, éprouvé et rapide.
Préparation
Ce composé peut être préparé par la réaction de métathèse des sels sulfate de cobalt(II) aqueux et thiocyanate de baryum, le sulfate de baryum précipite, laissant le composé désiré en solution[4] :
- CoSO4 (aq) + Ba(SCN)2 (aq) → BaSO4(s) + Co(SCN)2 (aq)
Structure
Le thiocyanate de cobalt(II) trihydrate, Co(SCN)2.3H2O, cristallise dans le système monoclinique, groupe d'espace C2/c (no 15) avec a = 1,2490 (2) nm, b = 0,6024 (1) nm, c = 1,0740 (2) nm et β = 90,49 (1)°, le nombre d'unités par maille est de Z = 4[4].
Test de Scott
Le réactif de thiocyanate de cobalt peut être préparé par dissolution de 10 g de thiocyanate de cobalt(II) dans un mélange de 490 ml d'eau distillée et de 500 ml de glycérol.
Du glycérol est souvent ajouté à la solution pour stabiliser le complexe de cobalt afin de s'assurer qu'il ne devienne bleu qu'au contact d'un analyte et non à cause de la perte de molécules d'eau ou de groupements hydroxyles (–OH) participant au complexe hydraté, surtout si le test est effectué en recourant à la technique de chromatographie sur couche mince (thin layer chromatography, TLC) et que le support sèche trop rapidement[5].
Le test est effectué en plaçant environ 2 à 4 mg d'une substance cible dans un tube à essai, puis 5 gouttes du réactif de thiocyanate de cobalt. Après agitation, 1 ou 2 gouttes d'acide chlorhydrique (HCl) concentré (d'autres acides peuvent être utilisés[6]) sont ajoutés et le tube est de nouveau agité. Dix gouttes de chloroforme (ou d'un solvant de polarité similaire) sont ensuite ajoutées et le tube est fortement agité puis laissé à décanter jusqu'à séparation en deux phases. La couleur finale de la couche organique (chloroforme) est le résultat du test.
L'ajout du réactif de thiocyanate de cobalt produit à la surface des particules de chlorhydrate de cocaïne, une couleur bleue lumineuse (bleu pâle pour la cocaïne «free base». L'ajout et le mélange d'une ou deux gouttes d'acide chlorhydrique fait revenir la solution à la couleur rose du réactif de départ. Enfin, l'addition et le mélange de chloroforme produit une couche organique bleue à la fois en présence de chlorhydrate de cocaïne ou de cocaïne base.
La diphénhydramine et la lidocaïne donnent également une phase organique bleue. Ces composés sont connus comme de faux positifs pour la cocaïne. Si la procédure est modifiée en alcalinisant l'échantillon plutôt qu'en l'acidifiant, le test peut être utilisé pour tester le chlorhydrate de kétamine[7].
Sécurité
Le thiocyanate de cobalt(II) au contact d'un acide, dégage un gaz très toxique[Lequel ?][2],[8].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cobalt(II) thiocyanate » (voir la liste des auteurs).
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Cobaltous thiocyanate sur mpbio.com.
- ↑ Fiche MSDS
- F. H. Cano, S. García-Blanco, A. Guerrero Laverat, The crystal structure of cobalt(II) thiocyanate trihydrate, Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry, 1976, vol. 32(5), pp. 1526-1529. DOI 10.1107/S0567740876005694.
- ↑ (en) Rose Haddoub, Daniel Ferry, Philippe Marsal et Olivier Siri (trad. Réactif thiocyanate de cobalt revisité pour l'identification de la cocaïne par chromatographie en couche mince, CCM), « Cobalt thiocyanate reagent revisited for cocaine identification on TLC », New Journal of Chemistry, vol. 35, no 7, , p. 1351 (ISSN 1144-0546, DOI 10.1039/c1nj20234k, lire en ligne)
- ↑ Anna L. Deakin, A study of acids used for the acidified cobalt thiocyanate test for cocaine base, Microgram Journal, 2003, vol. 1, p. 40–43. article en ligne
- ↑ J.A. Morris, Modified cobalt thiocyanate presumptive color test for ketamine hydrochloride, J. Forensic Sci., 2007, vol. 52(1), p. 84–87. , DOI 10.1111/j.1556-4029.2006.00331.x.
- ↑ Voir aussi R32 dans les consignes de sécurité (dans l'infobox).

